Ngày 18/9, Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (Hội đồng Đạo đức) đã họp khẩn cấp để đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 của vắc xin Nanocovax với kết quả nghiên cứu tính đến ngày 2/9.
Hội đồng đã thống nhất về việc sử dụng các kết quả nghiên cứu thử nghiệm lâm sàng tính đến thời điểm đánh giá kết quả giữa kỳ giai đoạn 3, gửi cho Thường trực Hội đồng Tư vấn cấp giấy đăng ký thuốc, nguyên liệu làm thuốc để xem xét cấp giấy đăng ký lưu hành có điều kiện vắc xin Nanocovax theo quy định.
tối 18/9, GS-TS Trương Việt Dũng, Chủ tịch Hội đồng đạo đức trong nghiên cứu y sinh học Quốc gia, xác nhận vắc xin Nanocovax của Công ty Nanogen đạt các yêu cầu về an toàn và tính sinh miễn dịch. GS Dũng cho biết hội đồng chuyên môn sẽ sớm có thông tin báo chí chính thức về kết quả cuộc họp ngày 18/9.
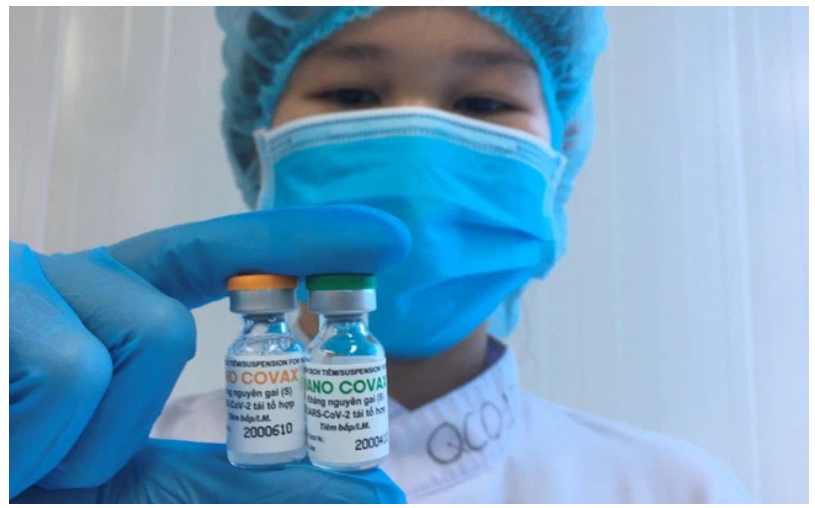
Vắc xin Nanocovax là ứng viên vắc xin tiềm năng nhất Việt Nam, hiện đang thử nghiệm lâm sàng giai đoạn 2 của pha 3 và đã hoàn thành tiêm 2 mũi vắc xin cho 13.000 người tình nguyện của giai đoạn 3. Vắc xin này cũng hoàn thành các xét nghiệm đánh giá tính sinh miễn dịch sau 42 ngày tiêm vaccine mũi 1 của giai đoạn 3a. Vắc xin Nanocovax được Công ty CP Sinh học Dược Nanogen (Nanogen) phát triển từ tháng 5/2020, dựa trên công nghệ protein tái tổ hợp, sử dụng những mảnh kháng nguyên vô hại (protein) của virus SARS-CoV-2 để kích thích tạo đáp ứng miễn dịch phù hợp.
Nếu được cấp phép, dự kiến công ty Nanogen sản xuất 30-50 triệu liều/ tháng sau tháng 10, cung cấp đủ 100 triệu liều vào năm 2022.
Cương Nguyễn
(Tổng Hợp)








Cùng chuyên mục
Chấm dứt hoạt động Chi nhánh Trung tâm Tâm lý Giáo dục Ngọc Bích
Longevity Medical tổ chức sự kiện gặp gỡ PGS.TS.BS Phan Toàn Thắng: Lan tỏa giá trị y học tái tạo vì sức khỏe bền vững
Thanh tra ‘gõ cửa’ điểm mặt loạt vi phạm, PNJ nói gì?
Có nên mua dự án Narra Residences tại khu đô thị Thủ Thiêm?
Tăng sức mua cho thị trường nội địa sẽ giúp Việt Nam ứng phó thách thức thuế quan?
Urenco 11 - Tiên phong trong hoạt động xử lý môi trường