Theo Reuters, Tổ chức Chương trình sức khỏe Medicare của Mỹ cho biết hôm thứ Năm ngày 1/6 rằng họ sẽ hạn chế thanh toán chi phí cho Công ty dược phẩm Eisai Co Ltd và Biogen Inc's về loại thuốc điều trị bệnh Alzheimer - Leqembi cho những bệnh nhân chưa đăng ký thử nghiệm lâm sàng trước đó. Đồng thời cũng không thanh toán nếu bác sĩ điều trị của họ không đủ điều kiện tham gia vào cơ sở dữ liệu của cơ quan y tế này.
Trước đó, Leqembi (lecanemab) đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt như là một loại thuốc mới được dùng để điều trị cho bệnh nhân giai đoạn đầu mắc bệnh Alzheimer.
Tuy nhiên, những lo ngại gia tăng về tính an toàn và hiệu quả trong thế giới thực của thuốc đã dẫn đến sự tranh cãi gay gắt giữa các nhà nghiên cứu, với một số ý kiến cho rằng loại thuốc này không nên cho phép sử dụng rộng rãi.
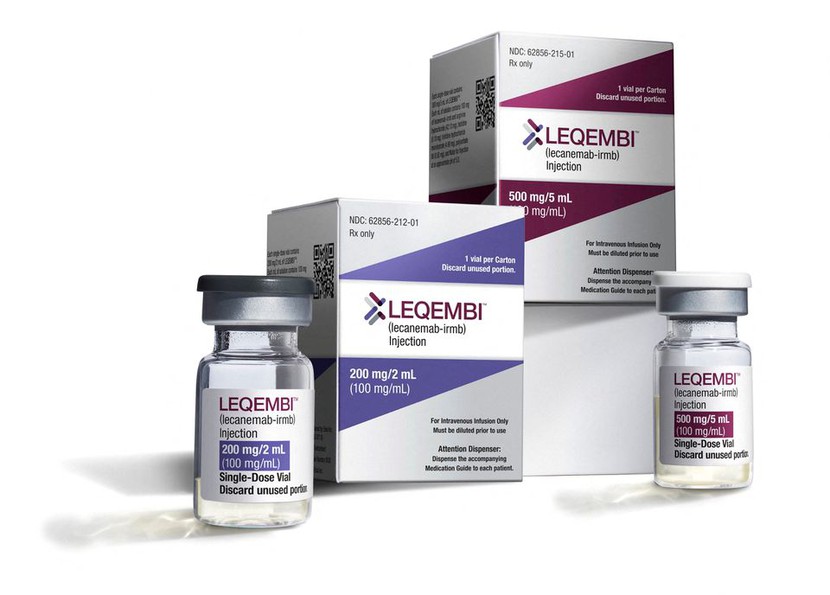
Leqembi được truyền hai tuần một lần và Eisai định giá điều trị vào khoảng 26.500 đô la Mỹ mỗi năm.
Medicare, một chương trình y tế của chính phủ dành cho người Mỹ từ 65 tuổi trở lên, hiện chỉ thanh toán cho Leqembi nếu bệnh nhân đã đăng ký tham gia thử nghiệm lâm sàng. Cơ quan này cho biết việc yêu cầu đăng ký này sẽ mở rộng quyền truy cập vào thuốc cho bệnh nhân, để họ có thể tự theo dõi rõ ràng và minh bạch hơn việc điều trị của mình.
Họ sẽ yêu cầu các bác sĩ gửi bằng chứng về cách thức hoạt động của thuốc trong thời gian tiến hành việc điều trị cho bệnh nhân và thu thập thông tin vào một cổng thông tin được cho là "dễ sử dụng" do Trung tâm Dịch vụ Medicare và Trợ cấp y tế (CMS) chủ trì.
Quyết định này đánh dấu lần đầu tiên Medicare yêu cầu thu thập dữ liệu cá nhân thông qua việc điều trị bệnh nhân đối với mục đích sử dụng của một loại thuốc đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ coi là an toàn và hiệu quả.
Để nhận được bảo hiểm của Medicare, người bệnh sẽ cần được chẩn đoán bị suy giảm nhận thức nhẹ hoặc chứng mất trí nhớ sớm do bệnh Alzheimer và có một bác sĩ đủ tiêu chuẩn để tham gia đăng ký.
Quyết định của CMS sẽ áp dụng cho tất cả các phương pháp điều trị bệnh Alzheimer, bao gồm cả Donanemab của Công ty dược phẩm Eli Lilly và Co (LLY.N) trước đó đã được báo cáo là đang thử nghiệm giai đoạn cuối, và có kết quả rất khả quan.
Lilly kêu gọi CMS sửa đổi quyết định của mình và kêu gọi cơ quan này cung cấp bảo hiểm đầy đủ của Medicare cho các loại thuốc điều trị bệnh Alzheimer được FDA phê chuẩn, nói rằng động thái này sẽ tạo tiền lệ cho tất cả các loại thuốc mới.
Người phát ngôn của Lilly cho biết trong một tuyên bố: "Chúng tôi tin tưởng mạnh mẽ rằng việc bắt buộc thu thập thông tin bệnh nhân sẽ tiếp tục đặt ra những rào cản không cần thiết trong việc điều trị bệnh cho họ. Và mâu thuẫn này cũng trái với lời hứa của CMS về phạm vi bảo hiểm rộng rãi cho tất cả những người Mỹ đáng được thụ hưởng trợ cấp y tế."
Công ty dược phẩm Eisai cho biết trong một tuyên bố: "Thật khó để hiểu việc cơ quan này tổ chức đăng ký lấy thông tin bệnh nhân sẽ tác động như thế nào đến quyền truy cập của bệnh nhân. Trước đây, các chương trình như vậy có quyền truy cập hạn chế đối với bệnh nhân ở các cộng đồng chưa được phục vụ", công ty cho biết thêm.
Trái ngược với những người chỉ trích Leqembi, gần 230 bác sĩ và nhà nghiên cứu đã đồng ký vào một lá thư ủng hộ việc phê duyệt thuốc trên lâm sàng. Bức thư nói rằng Leqembi không phải là thuốc chữa bệnh Alzheimer và nó có thể không hiệu quả với mọi bệnh nhân, nhưng nó là một bước tiến cơ bản trong điều trị căn bệnh hiện không có sự lựa chọn loại thuốc nào.











Cùng chuyên mục
Công nghệ miếng dán vi kim mở hướng mới trong điều trị mụn trứng cá
Vinmec Phú Quốc phẫu thuật nội soi xử lý “túi khuyết” tử cung cho người phụ nữ 3 lần mổ đẻ
Mô hình theo dõi bệnh phổi tắc nghẽn mạn tính tại nhà: Tin vui từ chuyển đổi số y tế
"Phương pháp giảm cân bằng tay không thuận" đang rất phổ biến ở Nhật Bản và Hàn Quốc, nhiều sao nữ áp dụng, có người giảm 7kg trong 60 ngày
Trước Tết, tôi học cách giữ sức: Bài học của một phụ nữ 35+ từng "đuối sức" ngay từ tháng Chạp
Người phụ nữ phát hiện vỡ túi độn ngực khi đi kiểm tra: BS khuyến cáo chị em nâng ngực muốn chơi thể thao cần lưu ý 2 điều kiện