Các bậc phụ huynh tại Mỹ đang lo lắng khi trường học sắp mở cửa trở lại nhưng các em dưới 12 tuổi vẫn chưa được bảo vệ, đặc biệt là trước biến thể Delta.
Tiến sĩ bệnh lý học James Versalovic tại Bệnh viện Nhi Texas (thành phố Houston, bang Texas) giải thích rằng trẻ em và người lớn có những khác biệt về sinh học nên cần có những nghiên cứu riêng.
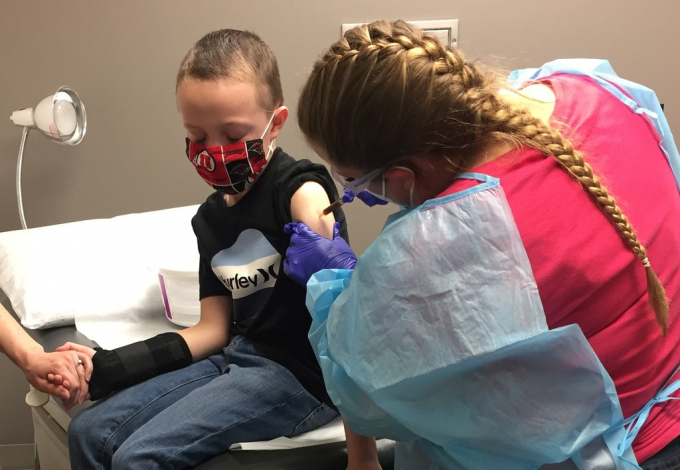 |
Tiến sĩ Emily Chapman, Phó chủ tịch Bệnh viện nhi Children’s Minnesota (bang Minnesota) cho rằng các nhà khoa học cần tính toán liều lượng để đảm bảo an toàn và có khả năng kích thích phản ứng miễn dịch ở trẻ. Để có thể phát triển vắc xin cho trẻ em, các nhà khoa học cần thực hiện thử nghiệm trên người lớn trước và dựa vào kết quả từ đó.
Vắc xin cho trẻ em phải qua 3 giai đoạn thử nghiệm lâm sàng mới được Cục Quản lý thực phẩm và dược phẩm Mỹ (FDA) phê chuẩn. Giai đoạn đầu đánh giá độ an toàn trên khoảng 20-100 trẻ khỏe mạnh. Vì là thử nghiệm cấp tốc nên giai đoạn 2 và 3 được kết hợp và các bước được thực hiện song song.
Trong giai đoạn này, các nhà khoa học theo dõi độ an toàn và kiểm tra hệ miễn dịch của trẻ có phản ứng với vắc xin hay không. Số trẻ tham gia giai đoạn này có thể từ vài trăm đến vài ngàn. Một số được tiêm vắc xin và một số được tiêm giả dược để so sánh kết quả. Sau khi bước này hoàn tất, công ty mới có thể xin FDA phê chuẩn.
Hồi tháng 8, FDA yêu cầu các công ty cung cấp dữ liệu an toàn của trẻ 6 tháng sau khi tiêm, trong khi ở người lớn chỉ là 2 tháng và tăng gấp đôi số trẻ em từ 5-11 tuổi tham gia thử nghiệm.
Theo tiến sĩ Versalovic, việc trẻ em tham gia các thử nghiệm của Pfizer và Moderna không gặp vấn đề nhưng việc mở rộng chương trình thử nghiệm khiến quá trình nghiên cứu kéo dài thêm ít nhất một tháng.
Ông cho biết các nhà khoa học đều đồng ý là điều này cần thiết để có thêm dữ liệu chắc chắn nhằm đảm bảo cho các bậc phụ huynh cho con tiêm vắc xin. Tiến sĩ Chapman cũng đồng ý khi nói rằng điều quan trọng nhất là đảm bảo tính chặt chẽ của khoa học.
Tiến sĩ Scott Gottlieb, cựu lãnh đạo FDA và hiện là thành viên ban quản trị của Pfizer, cho biết công ty có thể sẽ nộp dữ liệu để xin cấp phép vắc xin cho trẻ từ 5-11 tuổi trong tháng 9 và nộp đơn xin cấp phép khẩn cấp sớm nhất là tháng 10.
FDA sẽ xem xét dữ liệu và quá trình này được cho là mất nhiều tuần. Sau khi được phê duyệt còn một vòng của hội đồng cố vấn về miễn dịch của Trung tâm Kiểm soát và phòng ngừa dịch bệnh Mỹ (CDC).
Giám đốc CDC sẽ đánh giá những khuyến cáo của hội đồng cố vấn trước khi quyết định phê chuẩn. Giám đốc CDC Rochelle Walensky ngày 1.9 kỳ vọng sẽ nhận dữ liệu từ công ty vào đầu mùa thu và phần còn lại phụ thuộc vào FDA.



















Dự báo thời tiết đêm nay và ngày mai (3-4/9): Nam Bộ nhiều mây mây, có mưa rào và dông vài nơi
Sức mua tại siêu thị tăng mạnh, đơn hàng tắc nghẽn
Dự báo thời tiết đêm nay và ngày mai (2-3/9): Cả nước mưa rào và dông vài nơi
Siêu thị mở lại kênh bán hàng online, sức mua tăng đột biến
TPHCM đã đủ vaccine để tiêm mũi 1 cho 100% người từ 18 tuổi
TPHCM: Người đàn ông tự xưng là ‘Ban chỉ đạo phòng chống dịch’ la lối ở siêu thị bị khởi tố
Cùng chuyên mục
Hãng hàng không của Sun Group tiếp tục dẫn đầu về tỷ lệ đúng giờ
Nhà khoa học Mỹ: “VinFuture đưa đóng góp của phụ nữ khoa học ra ánh sáng toàn cầu”
Đề xuất mở rộng nguồn nhân lực giám định tư pháp trong lĩnh vực khoa học và công nghệ
Đề xuất đãi ngộ nhà khoa học ngang hoặc cao hơn thứ trưởng, bộ trưởng
Xây dựng hệ sinh thái nghiên cứu và nhân lực công nghệ cao cho các công nghệ chiến lược
Cáp treo Vinpearl Nha Trang lọt Top cáp treo đẹp nhất châu Á